一、假陽性產生的原因。
這是免疫學方法都逃不開的問題,但是各種方法學在忽悠別人的理由都不一樣,這里就詳細的介紹一下膠體金常見假陽性和假陰性的原因。
(一)抗體與膠體金顆粒間的作用力
大多數假陽性產生原因是相似性問題,即在通常結合反應中蛋白與膠體金顆粒特異性結合,結合過程中蛋白質被三種主要作用力吸附在膠體金表面。
1.電荷引力 氯金酸轉化為膠體金時,還原劑(通常是檸檬酸鹽)帶有的一層負電荷被吸附在膠體金顆粒表面。負電荷將吸引帶正電荷的蛋白且使其靠近結合區表面,從而可能造成假陽性的產生。
低于等電點的蛋白帶正電荷,可能會與膠體金顆粒表面發生強烈吸引作用,尤其在帶有富含賴氨酸和精氨酸的蛋白質區域低于賴氨酸等電點(PH10.4)和精氨酸等電點(PH12.5)時會帶有大量正電荷。
2.疏水作用力 一旦蛋白質彼此十分接近(距離約小于1nm),那么蛋白質的任何疏水區則可能與膠體金表面的疏水區接觸并與之結合。
因此富含非極性氨基酸(例如色氨酸、亮氨酸等)的蛋白質就會與膠體金表面發生強結合作用。
3.配位鍵結合力 配位鍵結合力是所有吸引力中最強的結合力,這是金原子(具有傳導帶電子的能力)和硫原子(帶有價電子)之間的強吸引力造成的。因此富含硫的氨基酸的蛋白質與膠體金顆粒表面產生很強的結合力。
當這三種結合力作用于膠體金標記顆粒時,會產生假陽性信號并且對檢測結果產生不良影響。
(二)假陽性產生的原因
圖5-10
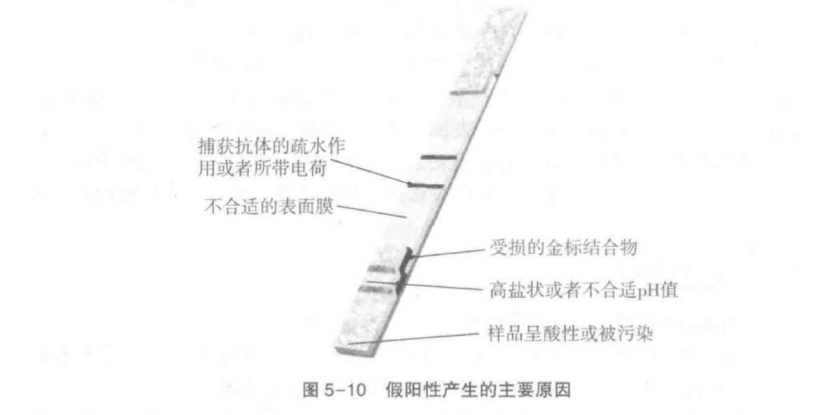
簡要描述了試紙條中需要關注的主要區域以及導致假陽性產生的大多數原因,但這些并不包括假陽性產生的所有原因和情況。總是,產生假陽性信號的所有可能原因與金標粒子、捕獲抗體、硝酸纖維素膜、所加化學試劑以及樣品都有密切關系。通過對這些潛在影響因素的充分理解,在實驗操作過程中即可根據某些特征,迅速判斷造成假陽性產生原因。
1.金標粒子原因 如果由于某種原因金標粒子表面沒有被蛋白質全部覆蓋而造成部分裸露或者金標涂得很少,那么在金標液干燥或者檢測過程中就會導致抗體丟失,但是裸露的膠體金顆粒均會被任何帶有正電荷的蛋白質或硝化纖維素或尼龍膜所吸附。導致當膠體金顆粒通過捕獲線時距離很小而物理接觸很大。因此對膠體金顆粒的有效包被且使蛋白質在儲存、處理或操作中不脫落這兩點至關重要。
除膠體金顆粒對捕獲線吸附外,標記抗體本身可能在特定操作條件下被捕獲線吸附。這種情況可由兩方面原因造成:一是電荷或疏水作用力,二是反應過程中酸性或離子環境。
過量金標粒子也會產生問題,一是可能增加捕獲線假陽性信號或者大量金標液通過捕獲線,二是檢測后增加過量金標粒子回流的可能性,而優質金標液則不需過量使用。
造成膠體金顆粒聚集成簇的原因很多,但通常是操作失誤造成過多膠體金簇堵塞膜孔。如果成簇原因是膠體金的疏水作用力,那么金標液在流動過程中膠體金顆粒會黏附在捕獲抗體上,無論待測物是否存在,金標抗體都會與捕獲抗體發生非特異性免疫反應。雖然 ELISA 技術中抗體間可能不經常發生類似反應,但這種情況會使硝酸纖維素膜上的標記抗體與捕獲抗體非常接近從而增加發生非特異性免疫反應的可能性。另外,特別是使用多克降抗體時可能會發生與樣品中其他待測物的非特異性反應。這種非特異性反應的發生與否主要取決于使用抗體的純度,
2.伴隨捕獲抗體而產生的假陽性信號 許多因素可能會導致捕獲抗體發生非特異性結合反應。產生假陽性信號的原因有以下幾方面引起:疏水作用力、非特異性免疫反應、抗體添加物、帶有大量正電荷、與膠體金顆粒吸附的捕獲抗體富含高濃度含硫氨基酸。標記過程中,這些因素都會使抗體與膠體金顆粒表面吸附并與其結合。實際工作中,作用于捕獲抗體的這些因素會影響到快速檢測技術的最終結果。
與固相支持物相關的硝酸纖維素膜很脆目接觸時很易破壞,因此在撕開膜的過程中應盡量避免與膜發生任何可能的機械接觸。如果應用捕獲抗體時膜被壓在捕獲抗體帶上,那么在樣品流動過程中,會提高金標粒子發生非特異性反應的可能性。
有兩個原因能使殘余膠體金顆粒吸附在捕獲抗體帶上,一個原因是金標粒子在膜中流速太慢,另一個原因是膠體金墊釋放速度太慢。如果孔徑太小或者檢測帶上沒有足夠活性物質,再加上硝酸纖維素膜與金標液或與吸收墊接觸不良,那么膠體金顆粒就會附著在捕獲抗體帶上。此外,由于硝酸纖維素膜是疏水的,會阻礙金標液流動。另外,有些黏性樣品(血清)也會使流速減慢。當檢測體系中樣品或活性物質的量不足以使金標沿著檢測帶移動時,膠體金顆粒也會黏附在捕獲抗體帶上。
如果檢測結果觀察時間較長,如超過 15min 時,膜會變干從而導致多余金標粒子
從吸收墊向干燥后的膜回流。這是由干干燥后捕獲抗體非常疏水,從而導致膠體金顆
粒從吸收墊流向干燥后的捕獲抗體。
3.化學試劑問題 有些快速檢測試紙條生產廠家在生產環節中會對硝酸纖維素膜進行封閉。對特定樣品進行檢測時,硝酸纖維素膜的封閉從層析分離(吸水物質)轉變成非層析分離(非吸水物質),目的是提高樣品和金標粒子在膜上的流速。
采用在蛋白溶液或表面活性劑溶液中浸泡進行封閉膜時會沖掉一些化學試劑,這些摻入膜中的化學試劑是膜生產廠家為避免膜完全干燥和保護其疏水性而預先設計的。
因此,沖掉一些化學試劑后的膜會較前更干燥,并目會使膜具有事強疏水性,從而在
捕獲抗體帶造成更加普遍的背景染色或假陽性信號。
采用過量蛋白或表面活性劑進行膜封閉會導致在樣品流動過程中產生高黏性從而降低樣品層析率。用不合適的反應液進行膜封閉會改變捕獲抗體特性,通過電荷作用力、疏水作用力或氫-硫作用力的提高會使捕獲抗體具有更大黏附性。因此,最好這些情況下進行膜封閉,例如當需要提高樣品或膠體金顆粒流動性和需要降低反應物濃度時。
不論是捕獲抗體、標記抗體或者樣品保護劑都會產生一些假陽性結果,比如實驗中添加硫柳汞(含硫和汞的化合物)和賴氨酸(一般在pH<10.4帶有大量正電荷)時要特別注意。
4.樣品問題 許多樣品中含有能夠與金標粒子或捕獲抗體發生非特異性結合的物質并能產生非特異性結果。舉例來說,一些含細菌的樣品,樣品中細菌非常疏水,目這些細菌會被部分破壞成細胞碎片,這些疏水的細菌碎片也會與捕獲抗體和金標粒子發生交叉反應。
此外,一些樣品會含有高濃度硫或 SH 基團或帶有很高正電荷,一些樣品會含大量分子或細胞分子,這些都會阻塞膜并對檢測帶上金標液的流動產生干擾。
另外,樣品在酸性條件變化會非常大。例如,尿液樣品最初pH 值 4~7、隨著細菌含量增加,樣品pH值會隨之降低。流動過程中酸性樣品會在捕獲抗體表面產生正電荷,與帶負電荷的金標粒子發生非特異性反應。如果樣品含大量酸性物質或者帶大量正電荷蛋白質,這些酸性物質或者正申荷蛋白質在到達捕獲抗體區之前可能與金標粒子發生非特異性結合,不僅掩蓋待測物與金標間粒子的結合信號(即降低特異性信號效果),還增加與膜上捕獲抗體帶上其他蛋白的的結合。
三、對假陽性結果的補救措施
無論偶爾還是重復出現的假陽性結果, 最合適的補救措施是對此類問題采用系統
診斷方法。圖 5-11 是系統診斷假陽性信號的的流程圖。
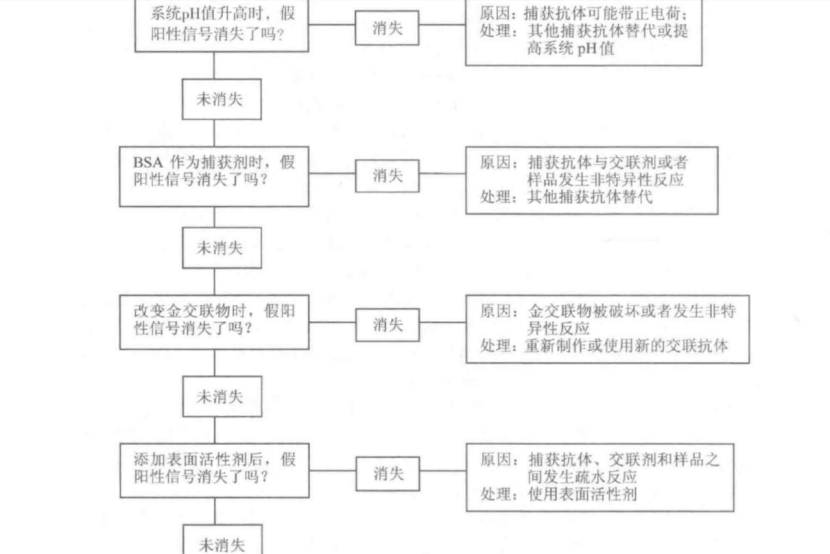
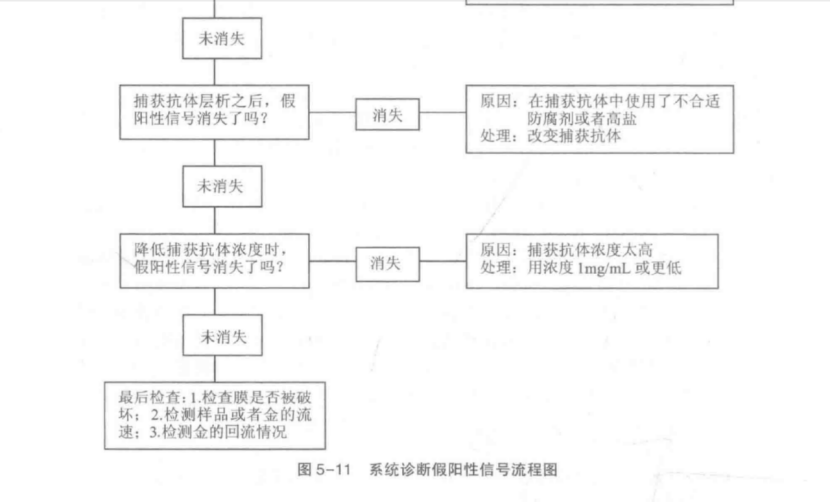
產生假陽性的主要原因首先是金標粒子與捕獲抗體的反應,特異性電荷吸引力、疏水作用力和金-硫結合力:其次應注意抗體、特殊樣品特性和跨膜流動特性的非特異性交叉反應,通過對照以上診斷流程能夠迅速找到問題根源。
對任何系統診斷方法來說,采用排除法進行對照時只能改變一個參數。舉例說明如下:①電荷。檢測體系 pH值的變化(pH值5~11)可以了解正電荷是否存在和膠體金顆粒與捕獲抗體是否結合。②疏水作用。這可能發生在固相中的捕獲抗體區或金標區。改變體系中表面活性劑濃度對于分析疏水作用是否是主要原因可提供幫助。③金- SH 吸引。最有可能發生在捕獲抗體帶和樣品浸人帶中的半胱氨酸和精氨酸基團。對這兩個區域的仔細檢查可以找出問題所在。
二、假陰性產生的原因
與假陽性信號診斷流程相比,引起假陰性信號的診斷流程需要考慮更多因素。主要是因為研發人員常常是在開始沒有可見信號的一無所知情況下進行實驗的。不過,解決此類問題的方法仍然依賴于對照線的出現與否以及及樣品和金標液沿著膜帶的流動情況等方面進行考慮分析。表 5-2 總結了產生假陰性信信號可能的大多數原因。

下面主要對絕大多數陽性樣品中偶然產生的假陰性結果進行詳細分析。圖 5-12簡要說明了產生假陰性結果的最常見原因。如果在臨慶陽性樣品中所有的檢測線(帶)均產生假陰性,那么可能是檢測線(帶)的設計有問題。假陰性產生大部分原因是由捕獲抗體和金標液引起,再就是檢測體系中膜的流動性不好(流速太快或太慢)、金顆粒釋放不充分、鹽量不足、體系中酸度不適宜。另夕 ,以下幾方面也需注意:檢測前 對樣品進行處理能讓抗體與抗原更好結合;對樣品進行稀釋可避免 hook 效應發生率:通過改變樣品成分可避免一些特殊抗原的假陰性發生。
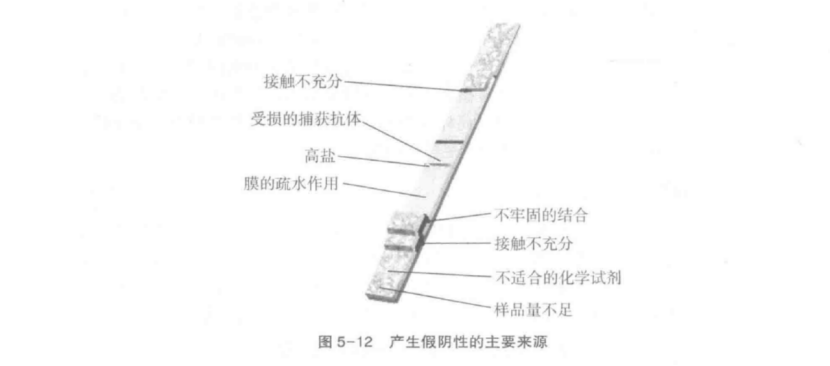
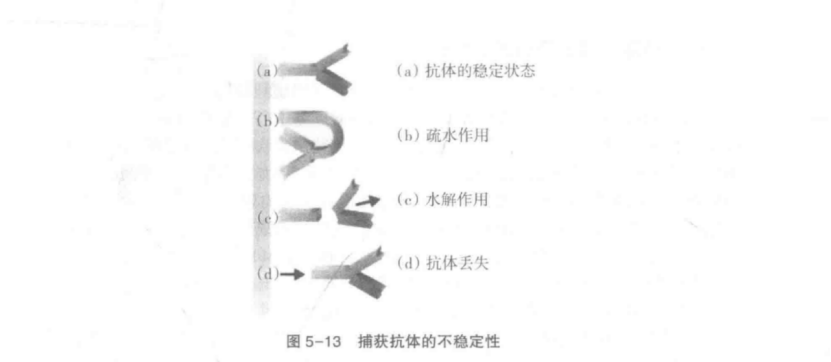
捕獲抗體在儲存過程中會變得不穩定目失去特異性活性,可能是由于水解作用(潮濕環境和干燥不充分)引起的,也可能是由于疏水作用被破壞(圖5-13)。后者可能由于抗體自身特性引起,通過更換抗體或去除捕獲抗體層后用表面活性劑處理膜即可解決。另外,抗體或金標液潛在的不穩定性要求檢測應當在可控干燥環境下進行。
假陰性產生原因常常是由樣品、金標液,或膜的流動性引起。很多因素都能導致類似現象發生,如樣品量不足、金標液或樣品墊上糖量不足、標記墊和膜結合不緊密或者標記墊材料不適合。這些因素可通過沒有控制線(帶)的試紙條進行檢測分析。如果金標液暴露于潮濕環境,那么其中的糖很可能會結晶從而導致金顆粒不能在膜上移動。
假陰性還有另兩個產生原因,一個是捕獲抗體或金標液沒有發生免疫反應:另一個是在樣品加入時膜上捕獲抗體丟失(圖5-12)。假陰性的產生也經常是由于金標在干燥和水合過程中被破壞,有沒有控制線(C線)說明金顆粒在樣品加入時是否被充分釋放,但不能說明捕獲抗體質量好壞或抗體免疫活性大小。
總之,快速檢測試紙條的研發需要經過實驗室小試階段、中試階段,最后進入大批量生產階段。每一個階段出現問題都必須再經過幾周甚至幾個月時間重新進行研發。
在這個過程中,優化檢測技術,完全熟悉實驗機制,對產生假陽性、假陰性結果的原因進行分析都需要花費大量時間和精力。當然可根據經驗對一些問題做出判斷。但不是每一個生產人員都具有豐富生產試驗經驗。所以,掌握實驗機制并對假陽性和假陰性產生的可能原因做出較快判斷,無疑可節約大量時間、材料和資金[1]。
三、膠體金試紙樣品墊上樣不吸收的原因
這個時候首先要確定樣品墊的材質。根據選用的樣品墊材質決定是否進行預處理,如果選用的是玻璃棉,多數產品出廠前已做親水處理,可直接使用。如選用的是聚酯棉,則需要對其進行親水性處理。采用浸泡工藝樣品墊進行預處理,可使其受表面活性劑充分接觸而獲得充分的親水性。也就是說樣品墊是否具有親水性不僅要看材質,還得看是否進行了預處理。
要解決這樣的情況,如果層析膜本身就是疏水性的,出現這樣的情況很正常,建議在處理液中加入一定量的表面活性劑如果是親水性的,出現這樣的情況,可能是BSA固化引起的,建議加一些T-20同時降低BSA的使用量。
四、膠體金C線不明顯的原因
如果檢測線明顯,但二抗線不明顯,問題不大,可能是二抗線的點膜濃度低了,或者因陽性過高導致檢測線結合和大量的金,自然對照線顏色變淺。如果檢測線也不明顯,基本就是標記有問題了,需要重新尋找適合的標記條件。
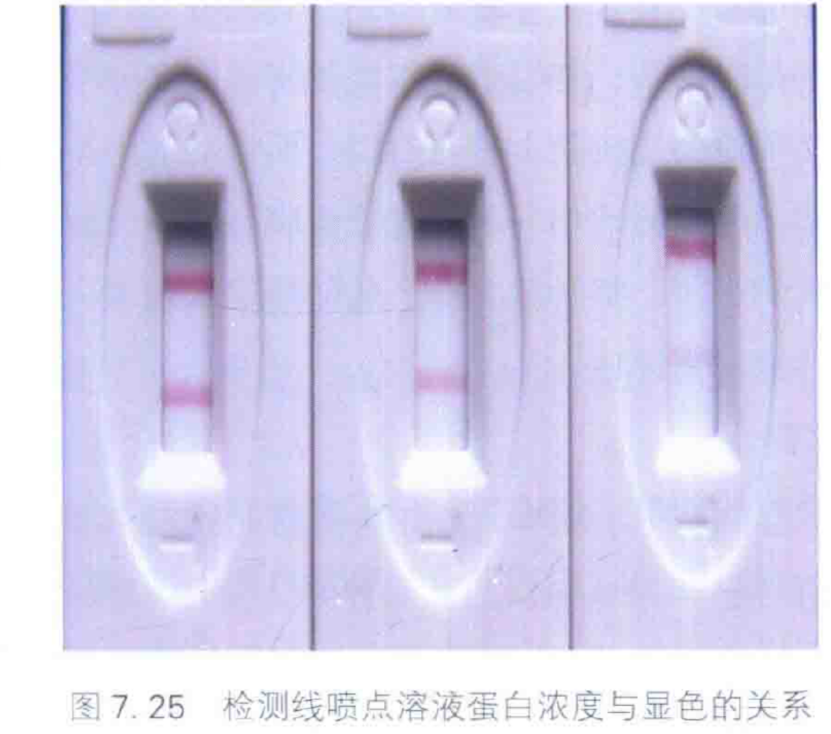
選擇適當的層析膜后,即可在膜真上印跡檢測線和質控線。以美國 BIO-DOT公司 XYZ-3000 型點膜儀為例,通常 蛋白溶液在膜上的點樣參考量為1uL/cm, 噴點溶液在膜上擴散,干燥后形成檢測線或質控線印跡,可通過點樣量調整印跡的寬度,點樣量越大則擴散后形成的印跡越寬,反之越窄(圖 7.24)。

如果檢測線或質控線的顯色過重或過淺,可以調整噴點溶液的蛋白濃度。如圖7.25 所示,試紙質控線蛋白濃度均為2mg/mL,檢測線分別為2mg/mL、1mg/mL、0.5mg/mL,檢測同一樣品時檢測線的顯色程度隨噴點溶液的蛋白濃度降低而減弱。
環境濕度也是點膜的重要影響因素,最佳濕度一般在 15%~35%。濕度過低,膜上容易聚集靜電荷,點膜時容易出現疏水斑,此時可以添加適量的醇類物質(如甲醇)加以改善(圖7.26)。濕度過高,膜上毛細作用加強,點膜容易引起檢測線或質控線變寬甚至擴散,嚴重時會造成層析膜結合蛋白的能力急劇下降。為了保證點樣時層析膜濕度的均一性,一般在點樣前應將層析膜置該濕度條件下平衡。

五、膠體金吸附的玻璃膜在NC膜上跑不動的原因
1.膠體金形狀不規則,很容易死;
2.膠體金緩沖液問題需要加一些表面活性劑,用來釋放,建議加T- 20,若效果不理想可以加SDS-L或SDS-F;要加BSA和PEG來保護抗體;
3.標記墊處理不好標記墊要噴糖來封閉玻璃纖維,避免膠體金和其靜電吸附;添加溫和的表面活性劑如SDS-L來增加釋放;
4.樣本墊如果上述情況都沒有問題,但效果仍然不理想,那么在樣本墊加SDS-L,濃度可以加大7%試試。
六、膠體金靈敏度降低的問題
1.首要是干燥,含水量越高,活性越容易丟失。環境濕度尤其重要,還有烤的要干;
2.鋁箔袋的密閉性要好,不要貪便宜買差的鋁箔袋;
3.加穩定劑。蔗糖、海藻糖、PVP、L-30、L-90D,and so on;
4.此外,影響試紙產品靈敏度和特異性的因素還有很多,如層析膜的寬度以及檢測線在膜上的相對位置,它們同樣會影響試紙產品最終的性能。點樣位置越靠近手柄端,免疫標記復合物通過檢測線的時間越滯后,反應時間相對增加,可使試紙的靈敏度升高,反之靈敏度降低[2]。
六、總結
快速檢測試紙條的原理和設計理論比較簡單,總原則是不能認為一個檢測產品中的最佳方案的每一步都適合于其他檢測產品,另外,樣品和待檢成分種類非常多,不是所有抗體都是以同一作用方式進行反應的。每個生產廠家膜性能特征都不一樣,需要對同一來源的膜或不同批次的膜進行重現性分析。
采用最佳工藝過程和最合適材料能夠獲得最佳結果。要生產出高質量的快速檢測試紙條,生產者不僅需要對所有參數和相關知識進行全面了解,而且應該清楚影響產品穩定性、可信度、重現性、靈敏度和特異性的因素。只有熟知每一個產品組件工作的機制,其中包括流體動力學和使用系統方法進行錯誤結果引起原因的診斷,才能保證生產出優質的快速檢測試紙條[1]。
參考文獻:
[1]劉麗,膠體金免疫層析技術,[M].鄭州:河南科學技術出版社,2017.9.
[2]張改平,免疫層析試紙快速檢測技術,[M].鄭州:河南科技技術出版社,2015.
注,文章來源于微信公眾號《醫學檢驗廢品加工車間》,如有侵權請聯系我們刪除