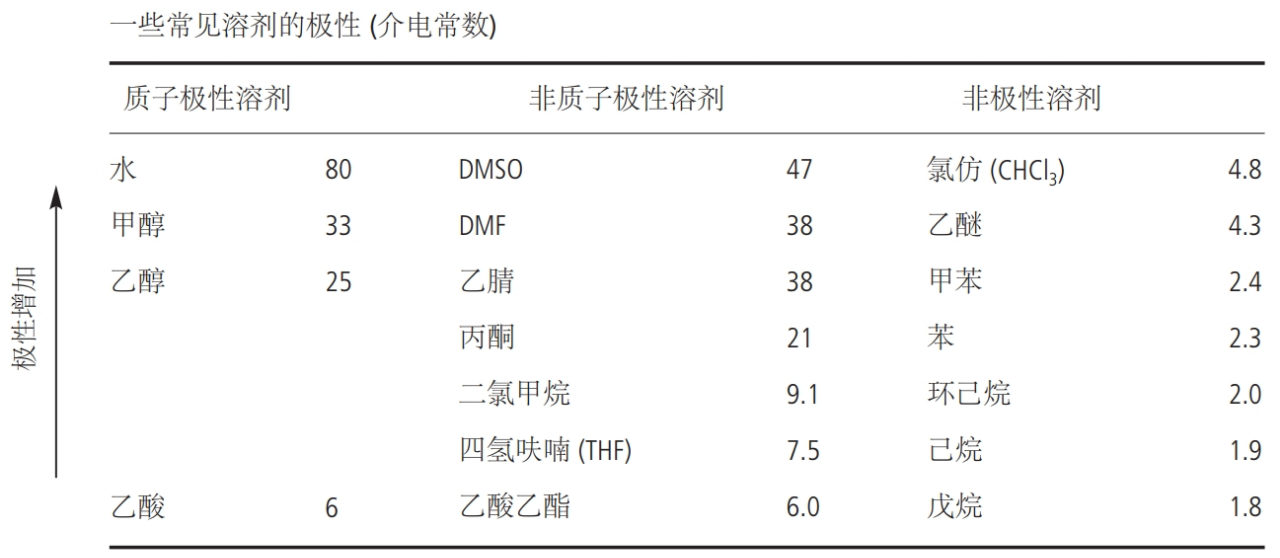
什么是極性溶劑?
極性是指分子中電荷分布不均勻,從而導致分子在電場中具有一個正電性朝向和一個負電性朝向的性質(zhì)。極性分子的電子云密度不均勻分布,使得分子在空間中有一個明顯的電荷分布方向。例如,水就是一個極性分子,因為氧原子電負性大,吸引電子效應強,使其周圍的電子云密度更大。


根據(jù)分子極性的不同,溶劑可分為極性溶劑和非極性溶劑。例如甲醇、水等,都屬于極性溶劑;如苯、乙醚等,都屬于非極性溶劑。溶劑的極性大小可以通過測定溶劑的介電常數(shù)進行判斷。另外,根據(jù)是否可以電離出質(zhì)子,溶劑還可分為質(zhì)子溶劑和非質(zhì)子溶劑,如水、乙酸等,均屬于質(zhì)子溶劑,又可稱為質(zhì)子極性溶劑。
水為什么可以溶解無機鹽?
水可以溶解無機鹽的原因是水可以溶劑化無機鹽的陰離子和陽離子。例如水溶解溴化鈉,是因為其氧原子上的 δ–可以穩(wěn)定正電性的鈉離子,氫原子上的δ+可以穩(wěn)定負電性的溴離子。
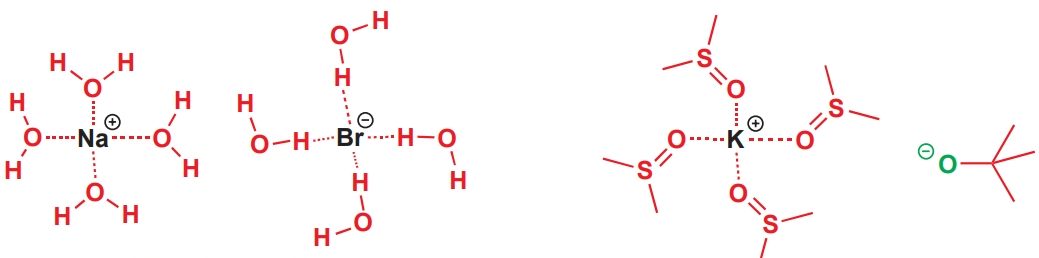
DMSO氧原子上的δ–同樣可以溶劑化陽離子,但由于它們并沒有可接近δ+區(qū)域,因此溶劑化陰離子的能力會差得多。t-BuOK在DMSO中可以使酰胺水解,而使用DMSO作為溶劑的原因就是它可以溶劑化K+離子,使t-BuO?因沒有得到溶劑化而不穩(wěn)定,它渴望通過找到一個質(zhì)子變?yōu)橹行苑肿樱醋鳛閴A消耗掉過渡態(tài)中的質(zhì)子。

溶劑是如何影響化學反應的?
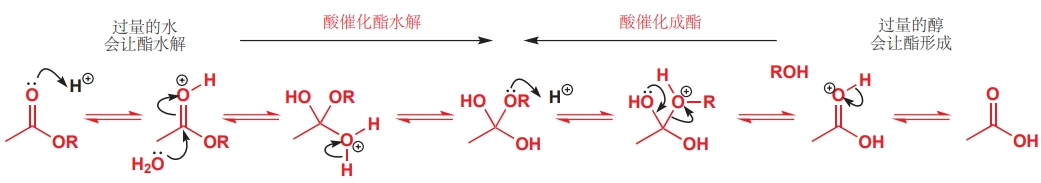
溶劑可以作為一種反應物參與反應。例如,在水中酯可以發(fā)生水解,在醇中酯可以生成,這是因為溶劑在溶解反應物的同時還是一種試劑,因其具有較高的濃度驅(qū)動了反應朝產(chǎn)物方向進行。
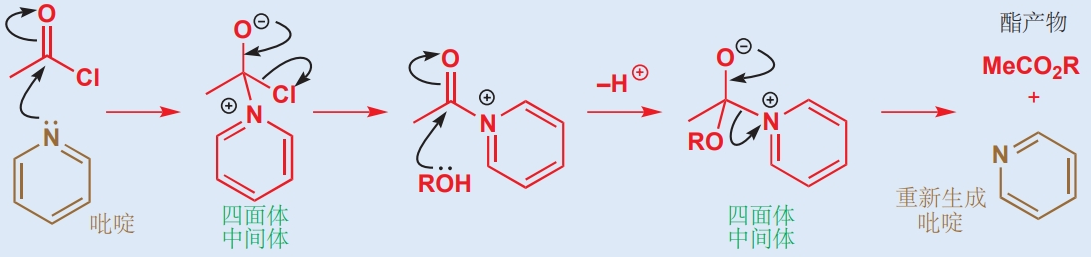
溶劑可以作為一種催化劑催化反應。例如,由酰氯與醇生成酯的反應通常在吡啶溶劑中進行,因為吡啶在溶解反應物的同時也能作為催化劑。
某些鹽在有機溶劑中的難溶性,可以被用來驅(qū)使平衡向所需的方向發(fā)展。例如,由溴代烷與碘化鈉合成碘代烷時,我們會選用丙酮做溶劑。這是因為碘化鈉在丙酮中的溶解度遠大于溴,因此溴化鈉會沉淀出來,這會導致有更多的起始原料轉(zhuǎn)化為產(chǎn)物用以復原平衡常數(shù)。

依靠溶劑溶解帶電荷物種的能力,溶劑可以通過使過渡態(tài)或中間體穩(wěn)定化或去穩(wěn)定化。例如二甲基乙酰胺在不同溶劑中發(fā)生C–N鍵旋轉(zhuǎn)的速率有明顯差異,這是因為基態(tài)的酰胺是離域的,極化程度大;而C–N鍵旋轉(zhuǎn)形成的過渡態(tài)的極性弱于基態(tài)。極性溶劑可以穩(wěn)定極性的基態(tài),使之能量降低,因而在極性溶劑中,由基態(tài)到過渡態(tài)所需要獲得的能量相比于非極性溶劑中更多,C–N鍵旋轉(zhuǎn)也更緩慢。

參考資料:Jonathan Clayden etal., Organic chemistry,delay譯
備注:文章來源于《化學筆記》公眾號,如有侵權,請聯(lián)系刪除