緩慢加熱非離子表面活性劑(Nonionic surfactants, NS)的透明水溶液����,到某一溫度后溶液發生渾濁��,表示表面活性劑開始析出,溶液呈現渾濁的最低溫度叫做“濁點”(Cloudpoint, CP)
----濁點的定義

濁點通常使用1%的表面活性劑水溶液測量。受水的冰點和沸點限制����,濁點的范圍是0℃至100℃���,對于濁點高于100℃的非離子表面活性劑����,常壓下無法直接測量。陰離子表面活性劑比非離子表面活性劑更易溶于水,通常會有更高的濁點(高于100℃)����,因此��,濁點是非離子表面活性劑的特征����。
一�、濁點的意義
將制劑儲存在明顯高于濁點的溫度下可能會導致相分離和不穩定�����。在濁點以上和以下��,潤濕,清潔和起泡特性可能不同�����。非離子表面活性劑在濁點附近及以下的溫度使用效果最佳�����,而低泡的表面活性劑應該在稍高于其濁點的溫度下使用�����。
二��、濁點的產生
濁點的產生來源于表活分子親水官能團與水分子之間的相互作用。非離子表面活性劑的親水基主要是聚氧乙烯基��。當溫度低于濁點時��,醚鍵氧原子與水分子中的氫原子以氫鍵結合而溶于水�,外觀為透明狀�����。氫鍵結合力較弱��,隨溫度升高逐漸斷裂���,因而使表面活性劑在水中的溶解度逐漸降低��,達到一定溫度時轉為不溶而析出成混濁液���。這種現象是可逆的��。
三、濁點的影響因素
1���、表面活性劑的濃度
隨著NS的升高,其濁點先下降后上升��。在濁點到達最低點之前��,表面活性劑濃度升高僅使膠束的數目增加�����,導致膠束之間相互碰撞的幾率增大,集聚的可能性增加����,因此易引起水相分離�����,使濁點降低����。濁點達到最小值時,隨著NS濃度的增大��,膠束形狀由球狀向棒狀轉變�����,從而導致膠束粒子的回旋半徑增大,溶液黏度增加�����,膠束彼此相遇的幾率降低��,導致濁點升高�����。
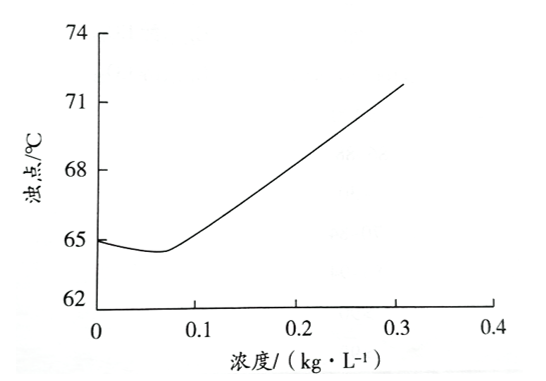
圖1 Tritox 100的濁點與濃度的關系
2、膠束增溶
非極性物質���,例如長鏈碳氫化合物���,由于增溶于膠束的內芯���,提高了濁點��。極性或可極化的物質,例如脂肪酸、醇、苯和苯酚等�����,由于增溶于膠束的外層��,降低了濁點�����。
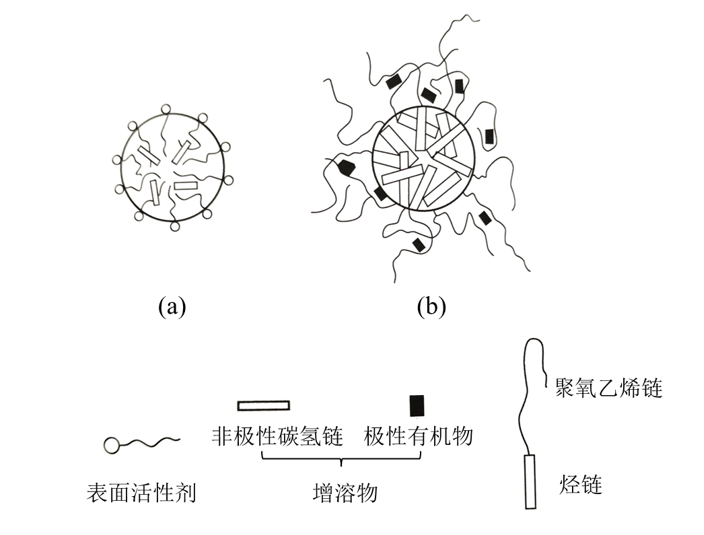
圖 2 增溶的不同方式
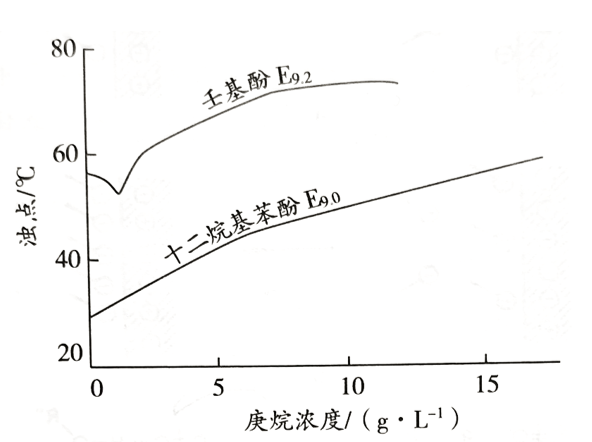
圖 3 庚烷在兩種非離子表面活性劑的1%溶液中����,增溶量與濁點的關系
3�、離子
因為離子對水分子的結合有影響��,從而影響了自由水分子的多少��,繼而影響了多縮乙二醇的水合程度而影響到濁點。例如OH-����、F-�����、Cl-、Br-����、和Na+�、K+�����、NH4+會促進水的相互締合���,這樣就使濁點降低�。而Ca(NO3)2、Mg(NO3)2和HCl會妨礙水的相互締合,這就使濁點提高。
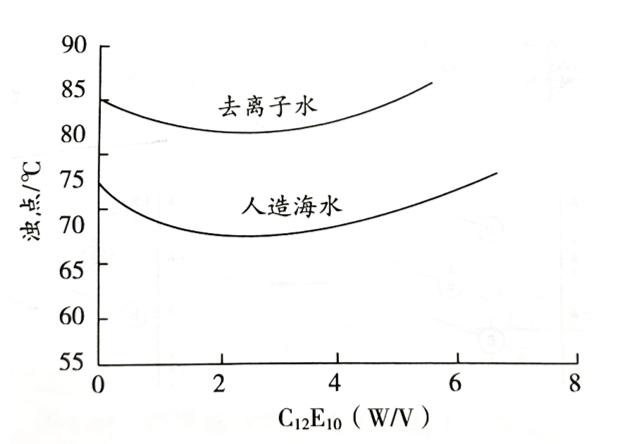
圖 4 C12E10在去離子水溶液和人造海水中濁點與濃度關系